辟谣:蝙蝠携带病毒却不生病,仅仅是体温高那么简单?
蝙蝠体内携带有众多对人类非常危险的病毒,包括埃德拉病毒、马尔堡病毒、亨德拉病毒、尼帕病毒和中东呼吸综合征冠状病毒等,这些病毒的流行曾导致大量人死亡,然而蝙蝠自己却从不因此生病,这是为什么呢?
网上一些文章习惯把这归因于蝙蝠较高的体温,说病毒在高体温下无法复制。如果这样的话,当蝙蝠冬眠的时候,体温只有6-30℃,病毒为什么不在这个时候大量复制呢?还有的人说是因为蝙蝠的DNA修复能力,这项能力对消除自身有害突变有重要意义,是蝙蝠长寿而且很少患癌症的法宝,与抵御病毒感染关系也不大。那么,蝙蝠不生病的真实原因是什么呢?
 斯里兰卡的蝙蝠
斯里兰卡的蝙蝠
哺乳动物防御病毒的机制大同小异。首先是发现异己成分,然后启动炎症反应,将病毒及其感染病毒的细胞都杀死,从而彻底消灭病毒。我们知道,作为地球上最简单的生命形式,病毒没有细胞结构,只是个遗传物质核酸(包括DNA和RNA)加上蛋白质外壳。当侵染细胞的时候,核酸进入宿主细胞内,而蛋白质外壳就此扔掉。
真核生物的遗传物质DNA主要存在于细胞核内,少量在线粒体和叶绿体中。因此,细胞质内有游离DNA是个非常危险的信号,很可能就是入侵的病毒。哺乳动物细胞内有两类特殊的蛋白质,分别是细胞质DNA感受器和炎性小体。细胞质DNA感受器能识别游离DNA,激活炎性小体,后者迅速启动炎症反应,并诱导被病毒侵染的细胞死亡。
炎症反应就是我们俗称的“发炎”,以牺牲少量被侵染的细胞为代价,换取整个机体的安全,通常来讲对机体是有好处的。
 炎症以发热、发红、肿胀和疼痛为特点
炎症以发热、发红、肿胀和疼痛为特点
这套机制对多数哺乳动物都很适用,唯独对蝙蝠不适用。作为哺乳动物中唯一的空军,蝙蝠体温超过40℃,代谢率非常高,经常有DNA损伤并被释放到细胞质内。如果蝙蝠的机体一发现细胞质游离DNA片段就启动炎症反应,那么蝙蝠整天不是这里发炎就是那里发炎,将会对它的正常组织细胞造成极大伤害。
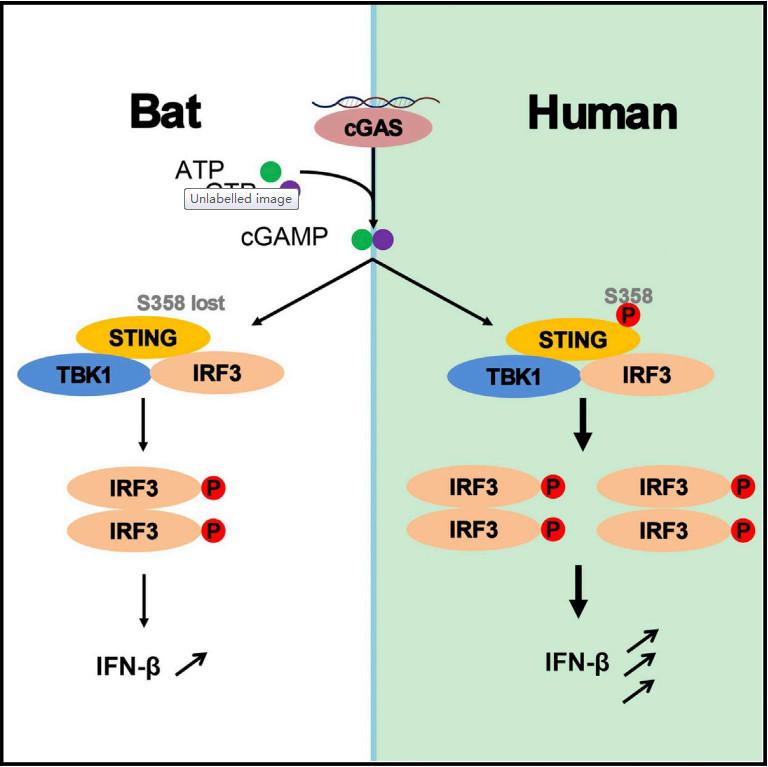
经对比发现,蝙蝠的免疫系统和其他哺乳动物很相似,但唯独缺少PYHIN基因座,表达AIM2细胞质DNA感受器和IFI16炎症小体的基因都位于这个基因座内。
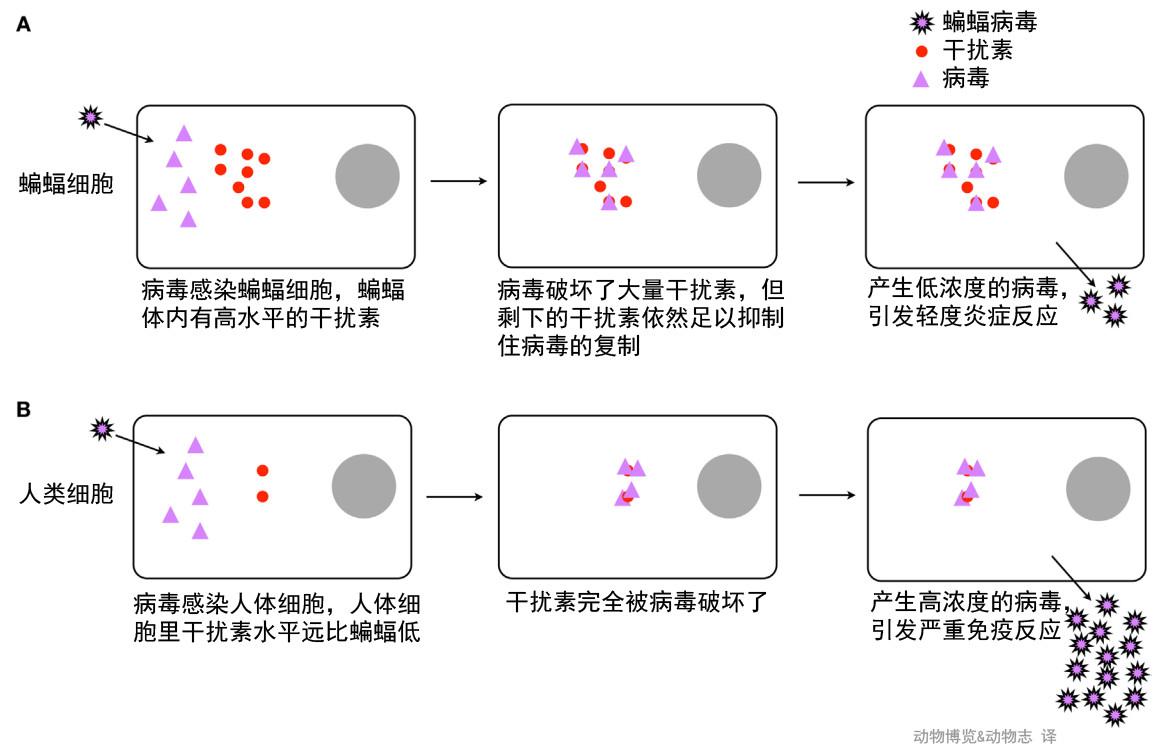
中科院武汉病毒研究所对中华菊头蝠、大卫鼠耳蝠和中央狐蝠三种蝙蝠进行研究,发现蝙蝠的细胞质DNA感受器以及炎症反应都是被抑制的。当蝙蝠体内发现游离核酸(包括病毒),只会产生轻度的炎症反应,而不像其他哺乳动物那样如临大敌。
研究表明,炎症的减轻并没有导致蝙蝠体内病毒浓度的显著增加,这是因为蝙蝠的炎症反应虽是被削弱的,但没有完全消除。病毒被允许继续在蝙蝠体内生存,但过度增殖受到抑制,无法在蝙蝠体内兴风作浪。
 蝙蝠和人体面对病毒侵袭时的不同反应,最终结果是蝙蝠只产生了轻度免疫反应,而人体产生了强烈免疫反应
蝙蝠和人体面对病毒侵袭时的不同反应,最终结果是蝙蝠只产生了轻度免疫反应,而人体产生了强烈免疫反应
炎症说到底是一种“杀敌一千,自损八百”的防御机制,虽然通常情况下对机体有益,但有时过激的炎症会对动物体造成损害。特别是,如果免疫系统杀死了大量细胞,并已经筋疲力竭,仍没有控制住病毒,那动物体就非常危险了。这时如果病毒卷土重来,或发生继发性细菌感染,免疫系统将无法组织起有效的抵抗,动物就只有死路一条了。因此,与其他动物非要和病毒斗个你死我活的做法相比,蝙蝠与病毒和平共处的策略不可谓不高明。
病毒与宿主在长期协同进化中进行生存博弈,最终将达成一种平衡。对宿主来说,在病毒侵袭下存活率高的个体有生存优势,能留下更多后代,后代将遗传到父母的优势基因。而对病毒来说,传播能力固然越强越好,致病和致死能力却是越弱越好,因为一旦宿主死亡,它体内的病毒都会随之死亡,宿主活得越久,病毒传播出去的机会就越多。
 澳洲穴兔与粘液瘤病毒的协同进化,病毒的毒性越来越弱
澳洲穴兔与粘液瘤病毒的协同进化,病毒的毒性越来越弱
宿主和病毒协同进化的最终结果,一定是宿主对病毒的抵抗力越来越强,病毒传播能力越来越强、毒性却越来越弱。下面举个例子,欧洲穴兔的入侵和泛滥对澳洲生态造成了很大破坏,这让澳洲人头疼不已。无奈之下他们使用了生物武器,在1950年将粘液瘤病毒有意释放到兔子当中,结果导致澳洲的兔子数量迅速从6亿只下降到1亿只。
就在澳洲人以为粘液瘤病毒将彻底解决掉兔子的时候,病毒和兔子之间却好像达成了某种默契,病毒毒性越来越弱,兔子免疫力却越来越强。到1991,兔子数量恢复到2~3亿只。人们为了消灭兔子,又在1996年使用了杯状病毒,2012年使用了毒性极强的K5病毒,至今仍无法控制住兔子。现在,人们已经意识到,单靠病毒消灭兔子是不现实的。
在自然选择压力下,病毒一定会渐渐在遗传和生物化学上进行优化,最终达到理想状态——持续传播而不引起宿主的严重疾病。因此,病毒对原生宿主总是友好的,而一旦进入新宿主体内往往掀起一阵血雨腥风。不光是蝙蝠,其他野生动物和我们人类体内都藏有很多病毒而相安无事,而这些病毒一旦进入其他生物体内就可能造成严重后果。在这一点上,蝙蝠和其他动物没有本质区别。
 入侵澳洲的穴兔
入侵澳洲的穴兔
蝙蝠与其他哺乳动物的一个重要区别,就是它体内的病毒种类似乎特别多,这是由多种原因造成的。蝙蝠会飞,活动能力远胜其他哺乳动物,而且它很长寿,相似体型的老鼠只能活1~3年,它却能活30~40年,因此蝙蝠有机会比其他哺乳动物接触和积累更多病毒。
此外,蝙蝠的群居习性使某一个体身上的病毒很容易在整个种群内传播。蝙蝠的群体规模非常大,经常成千上万。尤其是温带蝙蝠冬眠的时候,有时数以百万的蝙蝠都挤在一个洞里。如著名的布拉肯蝙蝠洞,里面居然住着200万只巴西犬吻蝠。
更重要的是,蝙蝠还广泛存在着不同种混居的情况,蝙蝠学者在调查中很少发现一个蝙蝠洞中只住一种蝙蝠的情形。例如在锦阳的调查就显示,大足鼠耳蝠、中华鼠耳蝠和水鼠耳蝠广泛存在混群现象。
 大群蝙蝠倒挂在树上
大群蝙蝠倒挂在树上
不同蝙蝠混群很容易发生交叉感染,病毒很方便在不同物种之间传播,多种蝙蝠甚至不同科、属都共享一个病毒库。拿蝙蝠和老鼠做一下对比,虽然老鼠物种数量(2300种)是蝙蝠(1200种)的两倍,但它们携带的人兽共患病毒种类却差不多,蝙蝠是62种,老鼠是68种。就单一物种来说,蝙蝠携带的病毒种类平均是老鼠的两倍,因此是比老鼠更危险的传染源。
在长期演化过程中,蝙蝠也适应了多病毒的环境。它的原生抗体库更大,不需经过特异性免疫应答即可产生高亲和力的抗体,而多数哺乳动物只有在遭到同一种病毒再次感染的时候才能实现这一点。
此外,蝙蝠细胞里干扰素活性较高,病毒的过度增殖受到了抑制。前面我们已经讲了,蝙蝠的炎症反应较弱,不会通过炎症反应激活大量的干扰素,可见蝙蝠把免疫工作做到了平时,令病毒对它的细胞无可奈何。而多数哺乳动物平时没有维持高水平的干扰素,试图只靠临门一脚的免疫反应消灭病毒,遇到毒性不是很强的病毒尚能应对,而遇到毒性很强的病毒只会使自身免疫系统不堪重负,反而使病毒大量增殖,把身体搞垮。
 蝙蝠和人体遭到病毒感染时的不同反应,蝙蝠体内高水平的干扰素是关键
蝙蝠和人体遭到病毒感染时的不同反应,蝙蝠体内高水平的干扰素是关键
如前所述,病毒与新宿主接触伊始容易引发严重后果,这符合进化规律。然而,蝙蝠携带的病毒似乎对其他动物特别危险。例如,埃博拉病毒与蝙蝠相安无事,到了人体内就成了世界上最危险的病毒,它的生物安全等级为最高的四级,而著名的艾滋病毒才是三级。这种病毒在非洲爆发过两次,每次都造成了尸横遍野的惨象。
前面已经讲到,蝙蝠由于会飞、长寿和群居等特点,身体里携带的病毒特别多,然而很多鸟类同样有这些特点,为什么鸟类就不会给人传播那么致命的病毒?原因就是,蝙蝠与人一样都是哺乳动物。
动物细胞的细胞膜具有半透膜的特性,只允许水分、脂质等部分小分子自由通过,有机大分子要想进出就需要借助细胞膜上的载体蛋白。载体蛋白具有特异性识别功能,只允许具有某种特异结构的分子通过,如葡萄糖转运载体蛋白只负责运输葡萄糖。病毒要想进入细胞,必须具有这样的特异结构,把自己冒充成细胞需要的某种大分子,骗载体蛋白给它开门。这样,这种特异结构就成了病毒进出细胞的“钥匙”。
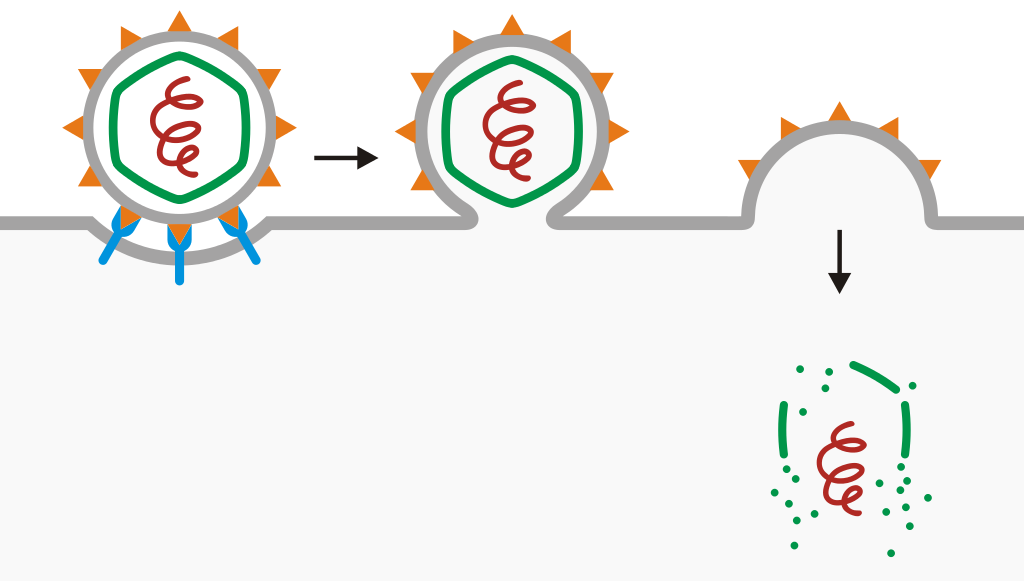 病毒进入细胞示意图
病毒进入细胞示意图
载体蛋白负责重要分子进出细胞,因而进化相当保守,大多数哺乳动物的载体蛋白都很相似。蝙蝠体内的病毒往往也有进入我们细胞的“钥匙”,换言之,我们的细胞膜上有这些病毒的受体。
而鸟类与哺乳动物分化有3亿年之久了,载体蛋白差异很大,鸟类的病毒很难再侵染哺乳动物的细胞。所以,能同时侵染人和鸟类的病毒少之又少,较常见的只有禽流感,而且禽流感在人与人之间传播的能力不强。
蝙蝠的病毒库是高度封闭的。蝙蝠的病毒库虽然在种内以及不同种蝙蝠之间是共享的,但几千万年来与其他哺乳动物交流甚少。由于蝙蝠会飞,而且休息地常位于其他哺乳动物难以到达的地方,它一直缺乏哺乳动物天敌,这就切断了蝙蝠病毒进入其他哺乳动物体内的主要途径。协同进化的原理前面已经讲了,越是陌生的病毒,越能引起致死甚至灾难性的后果。
 西表豹猫:猫科中唯一比较重要的蝙蝠捕食者
西表豹猫:猫科中唯一比较重要的蝙蝠捕食者
我粗略查阅了文献,现存约40种猫科动物中只有西表岛的豹猫以当地狐蝠作为重要猎物,我国南方有种白腹巨鼠很喜欢吃蝙蝠,除此之外蝙蝠就没有哺乳动物天敌了。犬科是哺乳动物中的重要捕食者,然而36种犬科动物没有一种捕食蝙蝠。与之相比,老鼠就有许许多多哺乳动物天敌。现在,蝙蝠的第三种哺乳动物天敌已经出现了,就是人类中的某些吃货。食用野生蝙蝠是非常危险的,如同打开装有众多致命病毒的“潘多拉盒子”。
还有一个比较巧合的原因是体温问题。多数哺乳动物的体温在37℃左右,如人类和老鼠为36-37.5℃,猫、狗为38-39℃,大象为36℃,鲸为37-38℃。而蝙蝠为了适应飞行带来的高代谢率,体温高达40℃以上。当蝙蝠携带的病毒侵染其他动物,引发炎症反应的发热,就是我们通常说的发烧。这本来是有助于杀死病毒的,这些在蝙蝠体内住惯了的病毒反而更舒服了,这下子又找到家的感觉了。
每种野生动物身体里都携带着我们意想不到的病毒,这是病毒与宿主协同进化的结果。而由于蝙蝠特殊的生理特性,体内的病毒比其他野兽更多、更危险,我们千万不要触碰这个潘多拉盒子。珍爱生命,远离野味,这不仅是保护野生动物,也是保护我们人类自己。
 埃及果蝠
埃及果蝠
参考文献
M Ahn, et. al. (2019). Dampened NLRP3-mediated inflammation in bats and implications for a special viral reservoir host.Jiazheng Xie, et. al. (2018). Dampened STING-Dependent Interferon Activation in Bats.T Schountz, ML Baker, J Butler, V Munster (2017). Immunological Control of Viral infections in Bats and the emergence of Viruses Highly pathogenic to Humans.M Ahn, J Cui, AT Irving, LF Wang (2016). Unique loss of the PYHIN gene family in bats amongst mammals: implications for inflammasome sensing.石红艳等(2006). 锦阳鼠耳蝠的初步研究.
Keyp宣布推出游戏性加密货币冷钱包 基于GB掌机打造
当年曾经风靡一时的任天堂GB掌机如今或许有了新的发力点,知名Web3初创公司Keyp日前宣布,将推出具有游戏性的加密货币冷钱包,基于GB掌机打造,玩家将利用GB卡带实现机密货币的存储和交易对接。站长网2023-05-25 04:22:130000Suno推出生成式音频AI模型 可将文字转化为歌词和音乐
近日,Suno公司推出了一款生成式音频AI基础模型。用户只需在Suno的Discord中输入“/sing”命令并加上提示词,即可生成两段大约30秒带歌词的音乐。据悉,目前该功能还在内测阶段,需要邀请链接才能体验,也可以在官网(www.suno.ai)进行候补排队。站长网2023-07-22 07:07:160001三星Galaxy S24系列将应用人工智能技术 相关专利已经提交
三星电子加速人工智能技术的研发,将在明年年初推出的GalaxyS24系列智能手机中大量整合人工智能相关的技术。据外媒报道,三星已经申请了“AIPhone”和“AISmartphone”商标,并完成了相关注册。这一系列的智能手机将具备自主收集和处理信息的能力,无需依赖中央服务器,从而加快信息处理的速度并提升安全性。0000从零复现Llama3代码库爆火 Karpathy大神称赞作者是个有品的人
最近,一个教你从头开始实现Llama3的代码库在网上爆火,吸引了无数开发者的关注。知名AI专家AndrejKarpathy一键三连(点赞、转发、评论),这个项目在社交媒体X上的转赞收藏量超过6.8k,GitHub上更是收获了超过2k的星标。站长网2024-05-22 00:48:490000OpenAI神秘模型,再次被Sam Altman提及
5月6日,OpenAI首席执行官SamAltman在社交平台分享了一条推文“我是一个优秀的GPT-2聊天机器人”。而在4月30日,Altman就提起过该模型非常喜欢GPT-2。按道理说一个只有15亿参数在2019年发布的开源模型,被反复提及两次就很不寻常。更意外的是GPT-2曾短暂上榜LMSYS的聊天机器人竞技场性能媲美GPT-4、ClaudeOpus等模型。站长网2024-05-06 10:54:560001